MSK前瞻性临床队列 MSK-IMPACT和MSK-ACCESS样本量突破10万之后,MSKCC的分子肿瘤中心 (Center for Molecular Oncology, CMO)主任 David Solit 最近在个人社交媒体上晒了这样一个截图,并补充到: 随着数十种tumor-agnostic和肿瘤特异性的基因组生物标记得到FDA批准,肿瘤以及胚系基因组检测应该被考虑用于所有需要系统治疗的癌症患者。 MSK-IMPACT中IMPACT是Integrated Mutation Profiling of Actionable Cancer Targets的缩写。IMPACT panel 可以检测的基因数量也经历了很多版不同的变化,从最早的341基因到410 基因到2017年FDA获批时的468基因,再到如今的505基因,可以同时进行MSI和TMB检测。 而MSK-ACCESS中的ACCESS则是指 Analysis of Circulating cfDNA to Evaluate Somatic Status,它从IMPACT中挑选了129个关键的肿瘤相关基因,在cfDNA中进行深度测序。 更值得关注的是,在「展示成果」的同时,David Solit 还提出了自己想到的,8个关于肿瘤NGS检测临床应用尚未完全解决的问题。 如果你目前就在这个领域中,也许其中有些 point 会给你启发。 MSK-IMPACT 和 MSK-ACCESS 样本突破10万例的时间是2023年2月,而2020年1月这个数字刚来到5万。 下图是当时他晒出来的样本量截图。 好巧不巧,该说不说。 3年前样本量突破五万的时候,David Solit 同样发表了一些他自己的想法和评论(可以看作未解之谜前传)。 我同样顺手把它整理出来分享给你,你可以看看这三年时间,他的想法哪些变了哪些又没变。 1. 所有晚期癌症患者都应考虑进行肿瘤NGS检测。肿瘤NGS历来被认为只是一个辅助诊断手段,主要是那些系统性进行靶向治疗的患者需要,这样的想法低估了其临床价值。 2. 肿瘤NGS检测对以下几项内容也很关键:确保正确的癌症类型诊断,这将影响手术、放疗和化疗的决策;了解患者复发和死亡风险;评估可遗传的胚系突变。 3. 一些专家认为肿瘤NGS和精准治疗约等于「夸大其词」。在MSK的经验中大约40%的晚期癌症患者治疗直接取决于肿瘤NGS检测结果。为什么这个比例似乎不高呢? 到目前为止,MSK队列中发现的最常见突变清楚地说明了更多患者并未从靶向治疗中受益的主要原因。如下图所示,我们对大多数基因突变(TP53、TERT、APC、NF1)驱动缺乏有效的靶向治疗。 可见,增加受益于肿瘤NGS检测的患者比例需要更多的新药开发。 4. 根据MSK的经验,更大范围的NGS检测可以一定程度上扩大指导范围。那测多少才够呢? 肿瘤NGS检测通常有3个结果:确定可信的可靶向驱动因素;确定可信的足以让细胞发生转化的非靶向驱动因素;没有找到可靶向的驱动因素。根据经验,更大范围的NGS检测主要是可能让第三组患者增加收益。 在少数情况下,识别被靶向测序遗漏的基因融合可能会影响治疗结果。将来在可靶向驱动因素的患者中识别伴发突变也可能促使靶向治疗的合理组合。 5. 更大范围的NGS检测目前看来可以识别预测药物敏感性的突变特征(比如 MSI),不过能够识别HRD或其他特征的WGS检测是否真的有临床价值仍有待确认。 6. 我们是否仍需要争论配对肿瘤和正常组织测序是否是最佳方法?越来越清楚的是最好对「正常」样本同时进行分析以确保突变不是来自胚系或克隆造血。 7. cfDNA 在哪里应用更合适呢?cfDNA显然比肿瘤组织NGS检测有一些好处。比如:更容易获得样本和更短的周转时间;更容易对患者进行重复采样;更好地反映肿瘤异质性。 然而,cfDNA 检测必须进行更深的测序,这意味着更高的测序成本和通常更少的检测基因数量。 由于肿瘤DNA脱落率低,就有可能出现假阴结果;而敏感性又因突变类型而不同,克隆性造血也可能会混淆结果。 因此,肿瘤和血液NGS检测可能会被证明是互补而非竞争的方法。医生需要能正确地识别可能因肿瘤来源DNA比例低而错过关键突变的患者。 8. MSKCC 接下来该怎么做?关键步骤是不断收集参与MSKCC前瞻性计划的数万名患者的临床治疗信息和检测结果数据。 我们需要更好地了解为什么病人从目前的治疗中获得了不同的益处。加快开发更有效的方法治疗那些现有方法无法获益的患者,为那些能够获益的患者找到毒性更小的方案。 9. 为了促进这项工作,MSKCC 同样是 AACR GENIE 项目的创始成员之一,这一计划将汇集世界各地机构的基因组和临床数据,更好地了解特定基因组图谱如何影响癌症患者预后。 10. 期待未来几年MSKCC的团队合作能够充分揭示基于肿瘤和血液NGS检测的应用潜力。 如果你对这篇文章感兴趣,欢迎通过邮箱或者微信订阅我的 「熊言熊语」会员通讯,我将第一时间与你分享肿瘤生物医药领域最新行业研究进展和我的所思所学所想,点此链接即可进行免费订阅。
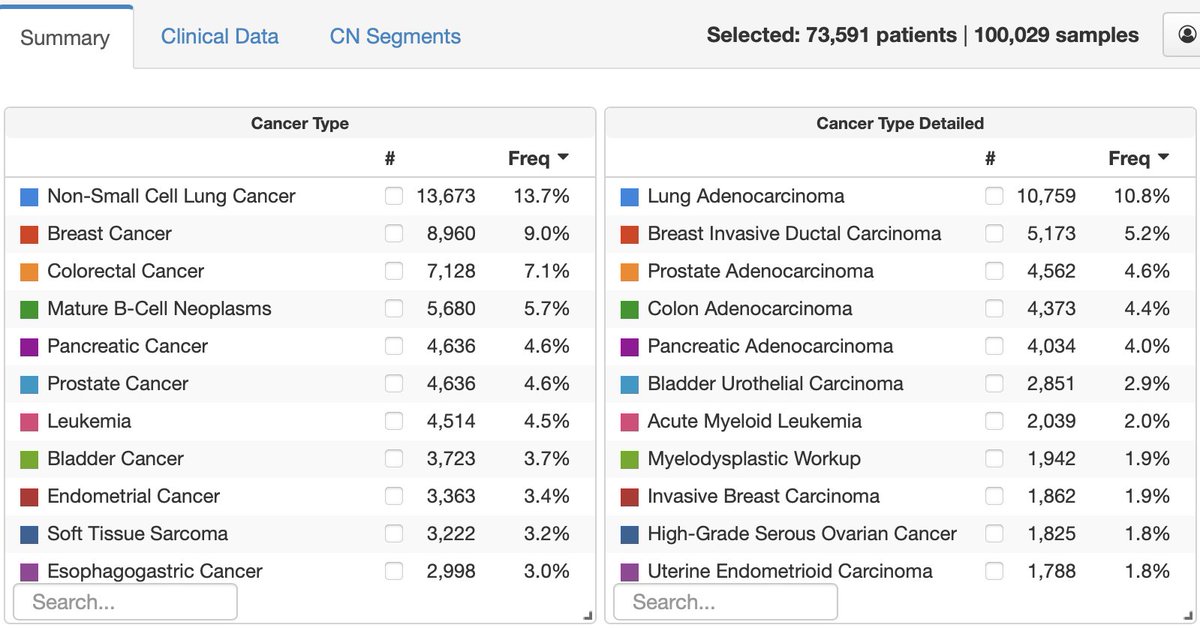
关于MSK-IMPACT和MSK-ACCESS
尚未完全回答的关键问题
5. 怎样才能提高肿瘤/胚系检测的可及性?如果需要进行基因组分析来确定最有效的治疗方法,无法获得这种技术的患者很可能就不能得到最好的治疗。从5万到10万样本的变与不变
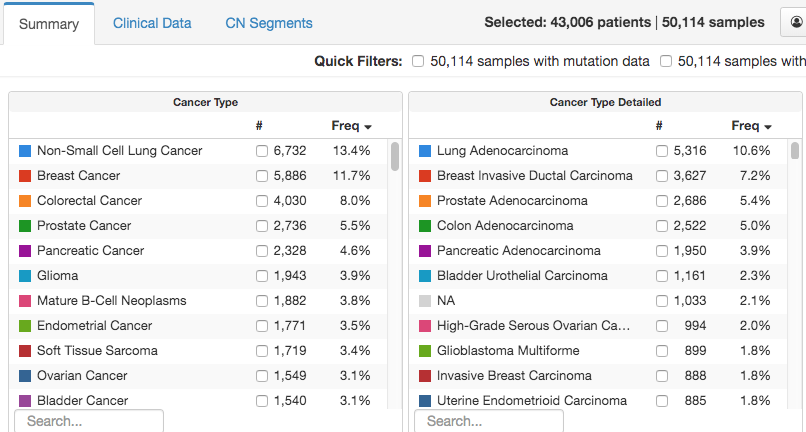
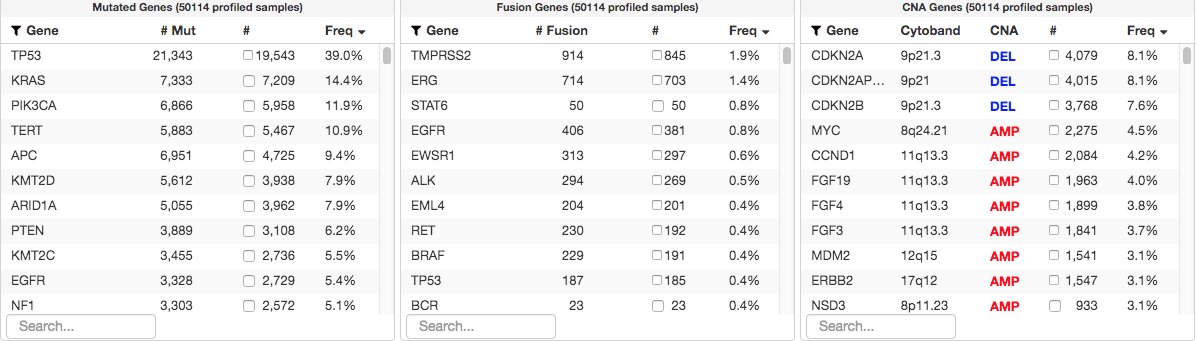

· 分享链接 https://kaopubear.top/blog/2023-02-04-mskcc-cmo-tumor-ngs-test/